-目次 -
1. はじめに
- 「GRAS」はアメリカで新規食品の安全性を保証する
- 米国フードテックを支える関連政府機関、食品法規制、「GRAS」について連載でご紹介
2. アメリカの食品安全を守る政府機関、FDAとUSDAについて
- アメリカの「食」を管轄する2大政府機関はFDAとUSDAである
- USDA (アメリカ合衆国農務省)は畜産業者と畜産品を規制している
- FDA(アメリカ食品医薬品局)は食品製造業者と食品を規制している
3. FDAの「GRAS」認証ー精密発酵商品の安全性を保証
- 「食品添加物」にはFDAの「市販前認証」が必須である
- 「GRAS」認証を受けると対象物質は「食品添加物ではないもの」とみなされ、複数の商品展開が容易になる
- 「GRAS」認証は、精密発酵商品の上市を加速させてくれる
- 1998年以降の「GRAS」は、「GRAS」申請プログラムによって承認されている
- 「GRAS」申請の指南書は「CFR 21 Part 170, Subpart E」である
4. まとめと次回予告
はじめに
「GRAS」はアメリカで新規食品の安全性を保証する
昨今の代替たんぱく市場は、主に植物性代替、細胞培養、発酵の3軸に分けられるが、その中でも発酵分野が今、注目を集めている。「発酵」というと、日本では特に馴染みの深い伝統的な発酵技術もあるが、今フードテック業界が目を向けているのが、「精密発酵」だ。伝統的な「発酵」の技術に、最新のテクノロジーを組み合わせることで、発酵食品の可能性を最大限に引き出した、次世代の「食」の一つとなっている。
その精密発酵分野で、既に諸外国では、スタートアップ企業が次々にビジネスを展開している。特にアメリカ市場は、投資額も参入企業数も、類を見ない速度で成長し続けている。そんなビジネス側面の裏側で、新商品の開発と流通を下支えしているのが、食品の安全性を保障する法規制である。特に精密発酵によって生産される新しい「食品」の多くは、国の機関、ないしは消費者に向けた、安全性の証明が上市前に必要となる。このような、アメリカの新しい「食品」の安全性を証明してくれるのが、Generally Regarded As Safe(「GRAS」)認証だ。
米国フードテックを支える関連政府機関、食品法規制、「GRAS」について連載でご紹介
そんな「GRAS」認証を切り口に、アメリカの最新フードテック事情を、主に精密発酵分野に焦点を当てて紹介する。今回から数回に渡る連載を通して、少しでも最新フードテックのワクワクを、法規制のリアルと共に楽しんでいただきたい。初回は米国政府機関と「GRAS」の関係性、また「GRAS」についてを、2回目は、「GRAS」申請プログラムについてより深く紹介していく。そして3回目以降からは、実際に「GRAS」認証を取得した、最新フードテック商品の事例を見ていく。
まず1回目の今回は、「GRAS」に関わるアメリカ食品安全省庁・部局と食品法規制のお話を紹介する。
アメリカの食品安全を守る政府機関、FDAとUSDAについて
アメリカの「食」を管轄する2大政府機関はFDAとUSDAである
アメリカでは食品の品質・安全管理を整備・規制する機関として、アメリカ合衆国農務省(USDA)とアメリカ食品医薬品局(FDA)の2つが存在する。USDAはアメリカ行政府内の一省庁であるのに対し、FDAはアメリカ合衆国保健福祉省(HHS)という省庁の中の、一部局である。
以下にFDAとUSDAの位置関係をまとめた。
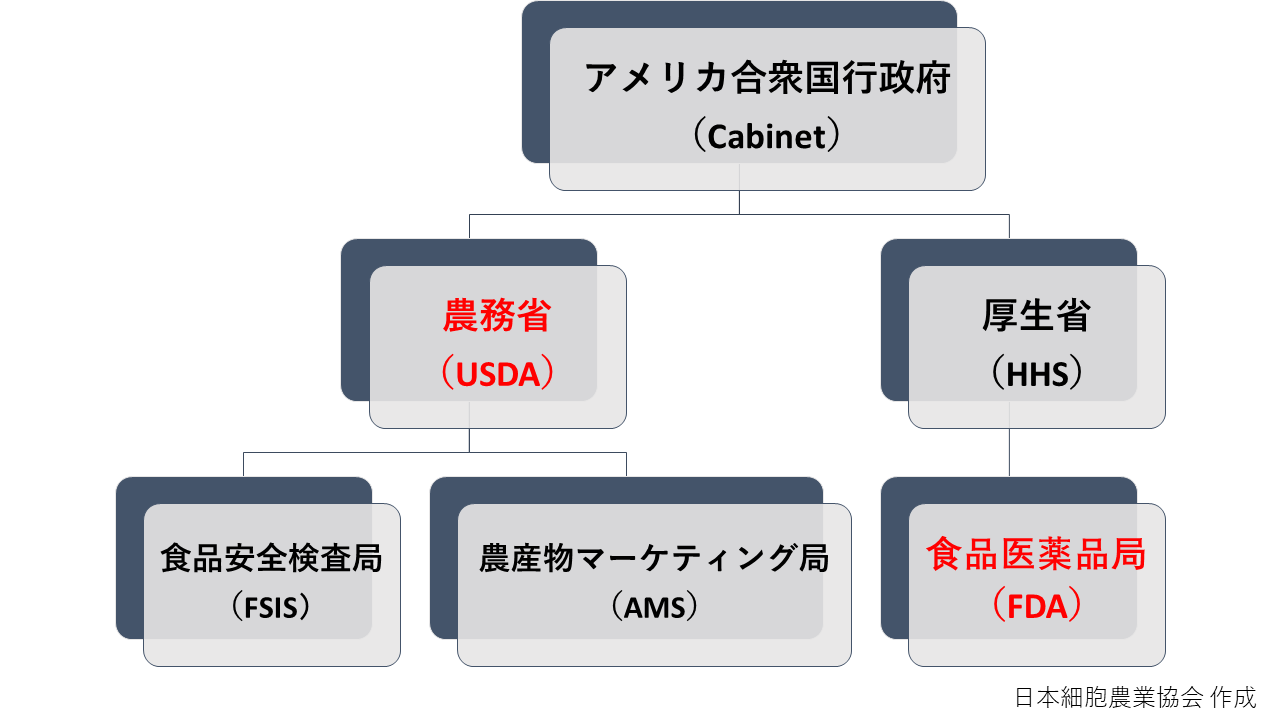
USDA (アメリカ合衆国農務省)は畜産業者と畜産品を規制している
USDA(アメリカ合衆国農務省)は、1862年に発足し、それ以降アメリカ合衆国の食料資源を長く守ってきた(USDA Food Safety and Inspections)。発足当時は、主要な食料資源であった穀物類に加え、畜産物の管理を、生産から販売までの管理を行っていた。また1912年からは、当時の畜産業局(Bureau of Animal Industry)が食用鶏卵の管理も担うこととなった(USDA Food Safety and Inspections)。
これらの歴史的背景を踏まえ、現在では食品分野の中でも、業種では畜産業、品目では畜産品と殻なし卵製品を対象に、生産のプロセスから販売時の食品表示までを管轄している。また具体的には、USDAの中でも主に畜産業・畜産品に関わる法規制を取り仕切るのがFSIS(アメリカ食品安全検査局)となる(USDA Food Safety and Inspections)。一方、農産品のオーガニック認証を取り扱うのは、AMS(アメリカ農産物マーケティング局)であり、オーガニック認証はあくまで農産品のマーケティング企画の一つ、という位置づけになっている(USDA Agricultural Marketing Services)。
以下に、USDA管轄対象の食品を、より詳しくまとめた(Food Standards and Labeling Policy Book, 2005、CFR Title 7CFR Title 9)。
- 畜産肉製品
- 殻なし卵製品(アメリカでは殻を割った液体の生卵が紙パックで売られている)
- 一部の畜産肉加工品
- ⋗3%の生肉(鶏肉を除く)を含むもの
- ⋗10%の鶏皮、鶏の内臓、鶏の脂肪を含むもの
- ⋗2%の加熱処理肉とその他残骸を含むもの
- ⋗30%の牛脂と家畜肉抽出物を含むもの
- ナマズ
- 農産物(オーガニック認証のみ、その他の規制はFDA)
FDA(アメリカ食品医薬品局)は食品製造業者と食品を規制している
前述のUSDAが発足した1862年、USDAの一部局として化学部が設置される。これが現在のFDA(アメリカ食品医薬品局)の元となる。1883年には、化学部の主任化学者に、Harvey W. Wiley 医学博士が任命され、「安心安全な食の提供」を求めた「純正食品医薬品法」(Pure Food and Drug Act/Wiley Act)が、1906年に制定された。そして1901年には、この化学部が化学局に改められ、1931年には現在のFDA(アメリカ食品医薬品局)に名称が変更された(USDA Food Safety and Inspections)。
その後、1938年制定の「連邦食品・医薬品・化粧品法」(Federal Food, Drug and Cosmetic Act)と共に、所轄範囲と権限を拡大させた。これを機に、1940年にFDAはUSDA(アメリカ合衆国農務省)から、当時のDepartment of Health, Education, and Welfare(アメリカ合衆国保健教育福祉省)、現在のHHS(アメリカ合衆国厚生省の前身)に移されることとなった(USDA Food Safety and Inspections)。FDAとして機能し始めるようになって以降、USDA部局との役割分担がより明確化された。結果、現在の管轄範囲が、業種では主に畜産業を除く食品業界全般、品目では主に畜産品以外の食品全般ということになっている。また、「連邦食品・医薬品・化粧品法」の制定からは、食品だけでなく、医薬品などの規制も行っている(FDA, 2022)。
USDAの管轄が主に畜産品だったのに対し、FDAはその他の食品全般を取り扱う。割合で見ると、アメリカで消費される食品の80%近くは、FDAが統括していることになるそうだ(FDA, 2022)。具体的には以下のようなものが対象となる(CFR Title 21)。
- 殻付き卵
- 農産物
- 魚介類
- 乳製品
- 一部の畜産肉加工品
- <3%の生肉(鶏肉を除く)を含むもの
- <10%の鶏皮、鶏の内臓、鶏の脂肪を含むもの
- <2%の加熱処理肉とその他残骸を含むもの
- <30%の牛脂と家畜肉抽出物を含むもの
- 健康サプリメント
- 飲料水
- 食品添加物
- 粉ミルク
- その他「食品」
FDAのGRAS認証ー精密発酵商品の安全性を保証
「食品添加物」にはFDAの「市販前認証」が必須である
USDAとFDAの違い、またアメリカ食品規制におけるFDAの主な役割がわかったところで、いよいよ今回の連載の肝、GRASの話に入っていく。そもそもGRASは、FDAが管轄する「食品」の中でも、「食品添加物」の規制を目的に設定されたものになる(CFR Title 21, Chapter I, Subchapter B, Part 170, Subpart E)。「アメリカ連邦食品・医薬品・化粧品法」の201条(s)と409条によれば、アメリカで「食品添加物」は「故意に食品に添加された物質のことを指す」とされ、「これら食品添加物は市販前承認をFDAから得る必要がある」とされている(FDA, 2018、FDA Premarket Approval)。
「GRAS」認証を受けると対象物質は「食品添加物ではないもの」とみなされ、複数の商品展開が容易になる
先にも述べたように、一般的に上市前の「食品添加物」にはFDAの市販前承認が必要だ。しかし、FDAの市販前承認は、上市前の各食品添加物を適宜FDAに審査してもらう方法と、FDAの「GRAS」認証を取得し安全な「食品添加物ではないもの」とみなしてもらう方法の、2通りがある。どちらもFDAによる規制であり、添加可能な量や用途は規定が設けられることは共通している。しかし「GRAS」認証を取得すれば、新商品を上市するたびに市販前承認を得る必要がなくなり、一つの新しい「食品添加物」から、複数商品を展開しようと考えている場合にはとても便利なのだ(FDA, 2018)。また市販前承認と「GRAS」認証では、安全性承認のプロセスも違う。前者は、個人が用意する資料に基づいた、FDAの審査のみが行われるが、後者は、FDAに加えて、外部の研究機関による審査も行われる(FDA, 2018)。
「GRAS」認証は、精密発酵商品の上市を加速させてくれる
精密発酵の多くは、まず食品(例えば牛乳)の原材料となる素材(カゼインタンパク質など)を微生物で生産し、それらを目的とする食品に組み込んでいく。そのため多くの場合、精密発酵や細胞農業で生産される物質は、「食品添加物」と法的にまず分類される。特に、精密発酵や細胞農業技術を用いて作られた素材の中で、1958年以前から一般的に摂取されていたり、1980年までに「GRAS」認証されたりしたものは、ほぼない。従って、精密発酵素材を使用した食品を商品化し、上市する上では、FDAによる市販前承認が求められる。ただ前述のように、「GRAS」認証を取得する方法もある。特に、一つの素材から複数の商品展開を目指すことが多い精密発酵の企業は、市販前承認ではなく「GRAS」認証を取得することを選択する。
アメリカでは、Impossible Foodsの精密発酵レグヘモグロビン(植物性代替肉で肉の赤みや味を再現する素材)、EVERY(元はClara Foods)の精密発酵卵白、Perfect Dayの精密発酵ホエイ(乳たんぱく)など、多くの精密発酵食品が開発され、上市まで実現してる。これらももちろん、FDAの「GRAS」認証を事前に取得したうえで、今のビジネスに繋げることができているのだ。「GRAS」認証は、各会社が、FDAという政府機関の信用を得るだけでなく、上市後に商品を購入する消費者に向けて、各会社が自社技術・商品の安全性を保証するための、重要な役割も担っている。
1998年以降の「GRAS」は、「GRAS」申請プログラムによって承認されている
厳密に言うと、「GRAS」と一口に言っても、更に細かく分類されている。1958年施行の「食品添加物の修正」を受け、同年12月9日に「GRAS」リストが作成された(FDA, 2018)。しかしこの時点では、「GRAS」物質の安全性を科学的な根拠を持って証明する体制が、整備されてなかった。そのため、FDAは1962年に、Federation of American Societies for Experimental Biology(米国実験生物学会連合)のLife Sciences Research Office(生命科学研究室)と契約し、「GRAS」物質の科学的な安全評価を開始した。その後、Life Sciences Research Office(生命科学研究室)によって召集された、「GRAS」特別委員会(SCOGS)が、1972年から1980年にかけて「GRAS」物質の安全性再評価を行い、食品応用における381の「GRAS」物質の安全性が保証された。これらがまとめられているのが、現在の「GRAS」リストになる(SCOGS (Selected Committee on GRAS Substances) 、FDA, 2018)。
しかし1997年には、FDAとSCOGSによる「GRAS」安全性評価のための科学的調査活動が、終了されることとなる(FDA, 2018)。その代わりとして、1998年に開始したのがGRAS Notification Program(「GRAS」申請プログラム)だ(FDA, 2018)。「GRAS」申請プログラムでは、基本的に新たな「GRAS」物質の安全性評価を、各申請者が指定した第三者専門研究機関に委ねる形になっている。「GRAS」申請者は申請時までに、安全性評価の科学的根拠を、第三者専門機関に用意してもらう必要があり、FDAはそれらの根拠を基に承認の判断を下す(FDA, 2018)。1998年以降に承認された「GRAS」物質は、全て「GRAS Notices Inventory」として記録されており、今日までに1077件の「GRAS Notices」が提出されている(GRAS Notices)。なお、1980年までに登録された「GRAS」物質に当てはまる、または類似する「食品添加物」であれば、新たに「GRAS」申請を行う必要はない。
「GRAS」申請の指南書は「CFR 21 Part 170, Subpart E」である
1998年以降に承認されてきた「GRAS」物質は、全て「GRAS」申請プログラムを通じて審査され、認証を取得してきた。その「GRAS」申請プログラムの全貌がわかるのが、アメリカ連邦規則集 第21条 第170項 E号(「CFR Title 21 Part 170, Subpart E」)である。オンラインで一般公開されているため、一般市民が誰でもいつでもアクセスできる。
この「CFR 21 Part 170, Subpart E」を一読すれば、もちろん誰でも「GRAS」申請プログラムを理解することができる。また、アメリカで新しい食品を開発・販売したいと考えている方は、これを読めば、実際の「GRAS」の申請方法まで把握できる。とはいえ、文書の内容は細かく複雑であることに加え、実際の申請書類や申請プロセスのリアルは、字面からでは読み取れない部分もある。そこで次回以降は、この「GRAS」申請プログラムの全貌と、実際の申請~承認までの流れを、実例と共に、具体的かつわかりやすく、まとめてお伝えしていきたい。
まとめと次回予告
「GRASと精密発酵」連載、初回の今回は、食品法規制を取り仕切る2大組織、USDAとFDAについて、また「GRAS」について、細かくお伝えした。「GRAS」の背景にあるアメリカ政府機関の関係性や、その中での「GRAS」の位置づけと内容、そして精密発酵食品における「GRAS」について、大まかには理解していただけたのではないだろうか。
次回は、いよいよ「GRAS」申請プログラムの中身を細かく見ていきたい。「GRAS」申請に欠かせない、「GRAS」申請書類(GRAS Notice)の中身や必要項目の全貌、また申請から承認までの流れを紹介していく。

